写在前面
运动障碍疾病曾被认为是神经病学的主要诊断分支,主要依靠现象学进行诊断,现已发展成为神经病学最具治疗导向的领域之一。系统的学习运动障碍疾病的治疗非常必要。
《Neurologic Clinics》杂志以“运动障碍疾病的治疗”为专题,邀请了最好的专家来提供全面、公平和权威的综述。这些综述用了很多的图片和表格阐述此类疾病的治疗方法,以提高每篇文章的临床和科学价值。非常感谢《Neurologic Clinics》的工作人员和撰写综述的专家教授们,本期我们团队翻译《Neurologic Clinics》杂志的运动障碍性疾病第十一篇,帕金森病运动症状的药物治疗,仅供大家学习。
关键点
1.虽然目前还没有针对帕金森病的神经保护疗法,但有大量药物可用于改善运动症状,使其成为所有神经系统变性疾病中治疗效果最好的疾病。
2.虽然左旋多巴仍然是帕金森病治疗的金标准,但数十年来,酶抑制剂和多巴胺激动剂一直是增强中枢多巴胺活性的医学治疗基石。
3.医疗研究正在持续扩大,特别是从多巴胺能领域药物扩展到涉及多个基底神经节突触传递通路的刺激或抑制非多巴胺能受体的药物。
4.本综述根据MDS EBM综述更新(福克斯和同事2018年)的建议,概述了PD药物管理的现状。
简介帕金森病(PD)是第二种最常见的神经系统变性疾病,估计全球有600万人受到影响。帕金森病的患病率在1990年至2016年间增加了74%,预计到2030年,患病率将进一步增加2-3倍。帕金森病的临床运动特征包括运动迟缓、肌强直和远端不对称的5-hz静止性震颤。运动迟缓是帕金森综合症的核心症状,表现为运动速度和幅度降低,尤其是在重复运动时运动幅度的降低。运动迟缓影响日常活动的各个方面,比如步态缓慢、步幅缩短,书写及使用餐具时手指不灵活、声音嘶哑和言语低沉。虽然目前还没有治疗或干预可以减缓PD的进展,但最近对PD发病机制中涉及的分子途径的研究揭示了多种新的药物干预靶点,可以改变PD的进展。其中最突出的是直接或间接针对a-突触核蛋白稳定的方法,包括小分子伴侣、葡萄糖脑苷酶增强剂、LRRK2抑制剂和旨在防止致病的a-突触核蛋白组装的细胞间传播的抗a-突触核蛋白免疫疗法。这里不再进一步讨论这些方法。相反,我们的目标是回顾大量且越来越多的药物,这些药物已被证明可以显著改善帕金森病相关的运动症状,使其成为所有神经系统变性疾病中治疗效果最好。
抗帕金森病药物的种类使用颠茄提取物治疗帕金森病运动症状的第一个成功的药理学疗法是偶然发现的(见后面的讨论),其作用主要是对震颤和强直。纹状体多巴胺的中枢传递缺乏是导致帕金森病运动症状的主要机制。对这一机制的认识使得帕金森病的药物治疗取得了突破性进展,为多巴胺药物替代治疗改善帕金森病运动症状提供了理论基础。多巴胺能药物自从将左旋多巴作为恢复纹状体多巴胺传输的一种方法被引入以来,这一基本策略的多种改进已经得到发展,包括使用酶抑制剂来改善左旋多巴的中枢传递或增强中枢多巴胺活性,以及开发直接作用的多巴胺受体激动剂(图1)。
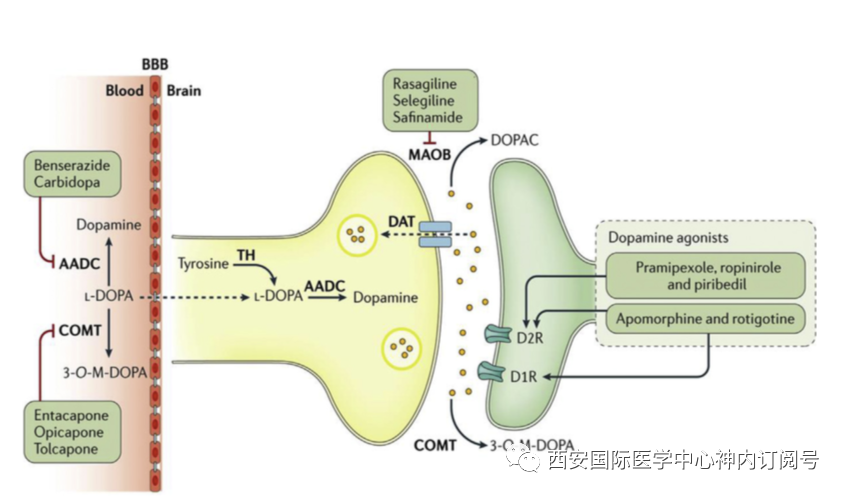
图1:黑质纹状体多巴胺突触的示意图,显示了多巴胺能药物治疗PD运动症状的部位和作用方式;AADC,芳香族氨基酸脱羧酶;BBB,血脑屏障;COMT,儿茶酚-O-甲基转移酶;DOPAC,3,4-二羟基苯乙酸;MAO-B,单胺氧化酶B;TH,酪氨酸羟化酶。(Poewe W, Seppi K, Tanner CM, et al. Parkinson disease. Nat Rev Dis Prim. 2017;3:1-21;)
左旋多巴左旋多巴是多巴胺的芳香氨基酸前体,与多巴胺不同,它能够穿过血脑屏障,在中枢芳香族氨基酸脱羧酶(AADC)的作用下,转化为多巴胺。这一过程发生在残存的黑质纹状体投射神经元上,影响突触前膜神经递质的储存和释放,但也可能发生在5-羟色胺能神经元中,导致纹状体中无调节突触多巴胺释放。20世纪60年代,左旋多巴可以显著改善帕金森病运动症状被人们所发现,此后的多个随机对照试验证实了该药控制早期帕金森病运动症状的疗效。直到目前为止,可能除了多巴胺激动剂阿朴吗啡以外,还没有发现任何药物能与左旋多巴的症状效应相媲美。口服左旋多巴制剂与非脑渗透抑制剂AADC(卡比多巴或苄丝肼)的组合剂型,可以提高中枢生物利用度,减少外周多巴胺能副作用,特别是恶心。标准口服左旋多巴制剂的半衰期很短,约90分钟,需要每天多次给药,而肠道吸收主要发生在十二指肠和空肠近端,这使得全身性给药容易受到胃排空延迟或膳食氨基酸竞争空肠吸收的影响。这些外周药代动力学因素加在一起会引起左旋多巴血浆水平的波动,这是长期治疗导致运动反应波动的主要原因。目前已研发出左旋多巴的不同口服缓释制剂,以提供更连续的药物输送,并在许多国家被许可用于治疗运动波动,并有几种新的方法正在临床研发中。此外,左旋多巴/卡比多巴肠凝胶制剂可用于经皮内镜胃造口术持续肠道输送,适用于对口服疗法难以治疗的运动并发症患者(请参阅下文“左旋多巴诱发的运动并发症的治疗”部分)。快速起效的左旋多巴制剂对于需要在关期进行“抢救”的患者很有用(见后面的讨论),左旋多巴/苄丝肼的分散制剂在欧盟有售;最近在美国(Inbrija)批准了用于肺内输送的可吸入粉末制剂。多巴胺激动剂多巴胺激动剂(DAs)是一类通过直接刺激纹状体多巴胺受体而发挥抗帕金森病作用的药物,与D2受体亚族有选择性亲和力。该类的第一个成员是1970年代引入的麦角类化合物溴隐亭,随后是其他几个麦角类制剂(表1)。在报告了麦角类溴隐亭、培高利特和卡麦角林引起的腹膜后、胸膜和心血管纤维化的报道后,它们在很大程度上被新的非麦角类化合物所取代,这很可能与它们在这些组织的成纤维细胞上表达的5-HT2B血清素受体的活性有关。
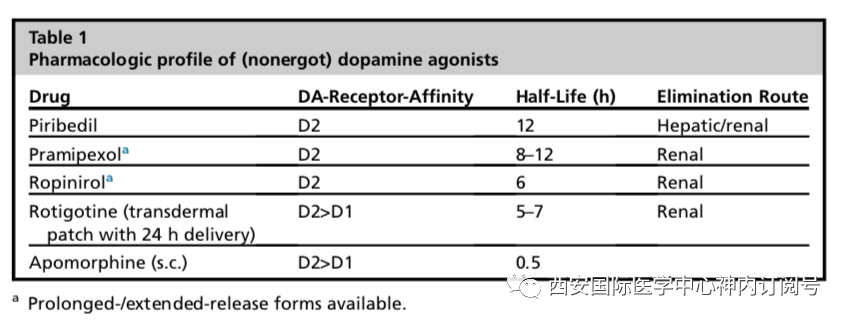
DAs是抗帕金森病随机对照临床药物试验中研究最广泛的一类药物,到2009年为止,已有29项此类试验涉及5000多名患者。作为早期单药治疗或左旋多巴的添加治疗,它们在改善PD的运动症状以及减少运动波动的疗效已得到肯定。也有确凿的证据表明, DAs在运动症状控制方面疗效不及左旋多巴,早期单药治疗引起运动障碍的风险较左旋多巴小。DAs的主要副作用是白天嗜睡和冲动控制障碍,这些副作用是常见的,且具有潜在引起灾难性后果的风险,例如开车时突然入睡或者由于无法控制的冲动行为而破坏社会关系和职业关系。酶抑制剂通过抑制单胺氧化酶(MAO)来阻断中枢多巴胺的代谢已经被认为是早期提高左旋多巴疗效的一种策略。由于非选择性单胺氧化酶抑制剂在摄入富含酪胺的食物后引起高血压危象(“奶酪效应”),其主要与与中枢五羟色胺能过度反应有关,不得不被废弃。选择性单胺氧化酶的B型抑制剂(主要是多巴胺的代谢)的开发为MAO抑制在PD的临床实践中铺平了道路。目前MAO-B抑制剂包括不可逆酶抑制剂司来吉兰和雷沙吉兰,以及具有额外间接谷氨酸能活性的可逆抑制剂沙酚酰胺。他们的抗帕金森病疗效小于左旋多巴或DAs。与左旋多巴/脱羧酶抑制剂联合治疗,可通过儿茶酚-O-甲基转移酶(COMT)减少改变左旋多巴的外周代谢。COMT抑制剂可延长左旋多巴的半衰期和生物利用度,从而延长各个剂量的作用时间。硝基邻苯二酚化合物恩他卡朋、托卡朋和奥匹卡朋已被证明可有效减少使用左旋多巴的患者运动波动的关期。非多巴胺能药物第一次成功使用药物治疗帕金森病的运动症状可追溯到19世纪60年代,当时奥登斯坦还是巴黎索尔彼特里尔医院夏科特医生的助手,他观察到含有颠茄生物碱的玄山药植物提取物疗效,如阿托品和莨菪碱等后来被证明具有抗胆碱能特性的物质,导致抗胆碱能药物在20世纪30年代被引入帕金森病治疗中。抗胆碱能药物在现代抗帕金森病治疗中的仍然被有限的使用,尤其是在控制帕金森病震颤方面。因为它们有可能诱发或加重认知功能障碍,所以不建议应用于65岁以上的受试者或有认知障碍的受试者。如果抗胆碱药不能有效治疗帕金森病震颤,或者由于不良反应难以耐受,注射肉毒杆菌毒素到手部和手臂肌肉可以有效控制震颤约3至4个月,此后必须重复治疗。与首次使用抗胆碱药物相似,N-甲基-D-天冬氨酸(NMDA)受体拮抗剂的抗帕金森作用也是偶然被发现的,而在此之前NMDA受体拮抗剂的抗帕金森作用机制还不为人所知。虽然效果不明显,金刚烷胺目前很少作为PD的初始单药治疗,但也是目前唯一一种被证实能降低左旋多巴诱导的运动障碍(LID)的药物(见下面关于左旋多巴引起的运动并发症的治疗部分)。在过去的20年里,人们对直接或间接改变基底节皮层运动回路的多种非多巴胺受体和通路的认识不断加深,为非多巴胺药物治疗帕金森病的运动症状提供了许多潜在的靶点。尽管进行了许多临床试验,但只有极少数药物最终被批准用于帕金森病的治疗。其中包括腺苷A2拮抗剂伊曲茶碱和钠钙联合通道阻滞剂以及具有额外MAO-B抑制活性的唑尼沙胺,这两种药物都在日本(伊曲茶碱最近也在美国销售)作为左旋多巴治疗反应波动患者的辅助疗法。
早期单药治疗 通过随机对照临床试验,大量证据均证实了左旋多巴、DAs或MAO-B抑制剂作为早期单药治疗帕金森病运动症状的疗效(表2)。尽管数十年来多巴胺能药物大量研发并进行了大量临床试验,左旋多巴仍然是疗效最明确的药物,也因此被认为是帕金森病运动症状药理学治疗中疗效的金标准。左旋多巴标准制剂半衰期短,每天需要服用3次,一些学者建议每天4次,间隔约4小时,以减少清醒时左旋多巴血浆浓度的波动。尽管与安慰剂相比,低至50毫克/次,3/日的剂量就可以显示出治疗效果,但通常需要300毫克以上的每日剂量才能观察到持续的临床疗效。帕金森病早期使用左旋多巴治疗的最主要限制是可能诱发运动并发症,这取决于年龄、疾病持续时间及剂量—很多持续使用超过3年以上的患者(见后面的讨论)
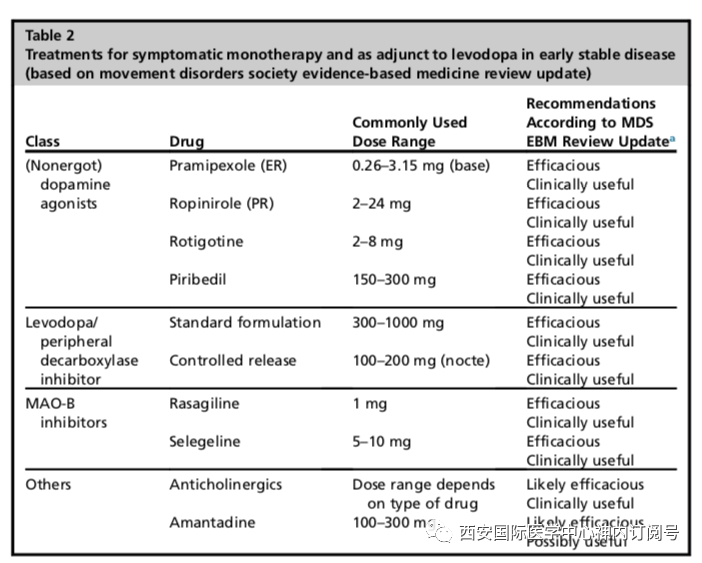
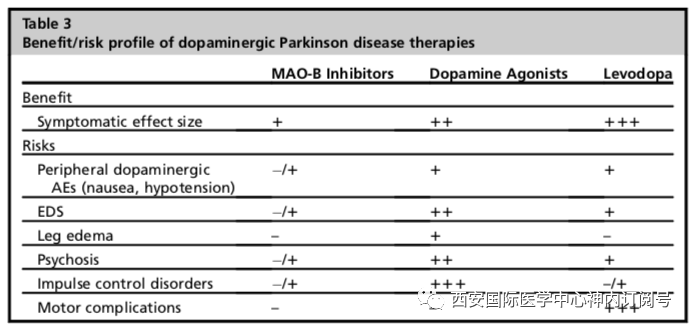
几项随机对照试验表明,与左旋多巴单药治疗相比,长达5年时间的DAs早期单药治疗发生运动障碍的风险明显更低,这使得很多学者建议在早期使用左旋多巴保护策略(DAs或MAO-B抑制剂),后期考虑使用左旋多巴辅助治疗,以更好的改善症状。不幸的是,这些试验结果和实践建议似乎被患者和医生曲解,这也导致了“左旋多巴恐惧”的现象-尽管很多患者的临床症状需要更好的控制,但药物的使用仍有所保留。最近在一项涉及1600多名早期帕金森病患者的大型实用主义试验中显示,通过PDQ-39的运动得分评估早期帕金森病整体症状控制情况,与DAs或MAOB抑制剂治疗组相比,左旋多巴治疗疗效更好。几乎所有的病人在左旋多巴保护药物(DA或MAO-B抑制剂)起始治疗后,最终都需要额外补充左旋多巴;尽管左旋多巴组早期出现了运动并发症,但经过7年的长期随访后,运动障碍的发生率并没有明显差异。尽管如此,对于疾病早期和症状轻微的患者,开始使用MAO-B抑制剂治疗是一个可行的选择:在ADAGIO试验中,约90%随机接受雷沙吉兰治疗的受试者在前9个月不需要额外药物,在DATATOP试验中,服用司来吉兰的患者需要添加左旋多巴的中位时间为24个月,而未服用司来吉兰的患者需要添加左旋多巴的时间中位时间为15个月;在PD-MED试验中,低于20%的患者因缺乏疗效而被分配使用雷沙吉兰或司来吉兰进行MAO-B抑制剂治疗。通常认为DAs的症状效应大于MAO-B抑制剂,尽管PD-MED试验不支持这一观点,相反,PDQ39试验结果显示MAO-B抑制剂组症状改善更明显。 在许多国家指南中,DAs仍然作为初始的单一治疗方案被推荐,特别是对于使用左旋多巴药物诱发运动障碍风险较高的患者,主要是在60-70岁之前发病的患者。这种治疗方案的优点是推迟运动障碍的发生,且药物使用方便,每天使用一次缓释或经皮贴片制剂,但由于需要左旋多巴辅助治疗,它不能长期有效预防患者运动症状。此外,与左旋多巴相比,DAs药物治疗方案的缺点包括症状控制不佳和白日嗜睡、幻觉、下肢水肿和冲动行为。在最近一项对接受DAs治疗的患者进行的前瞻性随访研究中,5年内冲动行为的累积发病率为46%。抗胆碱能药物或金刚烷胺等非多巴胺能药物在某些患者中作为早期单一疗法替代多巴胺能疗法的作用有限。例如,以震颤为主要症状的年轻患者可能在一段时间内能从抗胆碱能药物中获得症状的改善,而金刚烷胺单药治疗可在使用多巴胺替代之前,改善早期和症状较轻患者的运动症状。总之,左旋多巴仍然是改善帕金森病运动症状的最有效药物,主张尽早使用,以更好的改善症状并获得满意的生活质量。对于早期症状轻微或年轻且存在LID高风险患者,开始使用左旋多巴保护策略治疗可能是首选方案。应充分告知患者左旋多巴和DAs的不同风险与获益情况,告知对象应包括家属或护理人员,还应向家属或护理人员强调多巴胺激动剂引起过度嗜睡和冲动行为的风险。表3总结了用于治疗帕金森病运动症状的主要多巴胺能药物的获益和风险情况。
稳定期的辅助治疗目前已有几种药物已被证实可以增强左旋多巴改善运动症状方面的疗效。它们作为辅助治疗可以避免或延迟增加左旋多巴的总剂量或用药频率,并进一步强化左旋多巴作为首选治疗方案这一策略。随机对照临床试验研究结果表明,对于所有常用的DAs以及2种MAO-B抑制剂司来吉兰和雷沙吉兰(表4)都有这种效果。MAO-B和谷氨酸释放抑制剂唑尼酰胺的联合应用显示出类似的疗效,但目前仅在日本获得用药许可。 COMT抑制剂托卡朋也进行了一项临床试验,筛选了服用固定剂量的左旋多巴而无运动波动的患者,结果显示,COMT抑制剂托卡朋可以改善帕金森患者运动症状,但目前该药物说明书仅批准用于治疗运动波动的患者(见后面的讨论)。
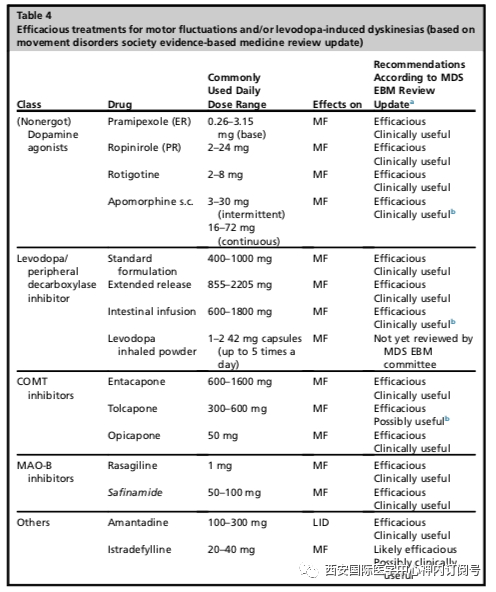
左旋多巴所致运动并发症的治疗简介大多数接受左旋多巴治疗的患者会出现运动并发症,包括症状波动和左旋多巴诱导的运动障碍、以及左旋多巴抵抗的轴向运动症状,包括冻结步态、构音障碍和吞咽困难。最常见的运动并发症是剂末现象、持续关期、开期延迟或者清晨运动障碍。这些通常被认为是晚期帕金森病患者最棘手的症状。运动障碍可能存在开关周期,包括开期舞蹈症、双相运动障碍和痛性关期肌张力障碍有关。尽管严重和致残性运动障碍的发生率较低,但通常对患者影响严重而需要医疗护理;轻度运动障碍的发生率较高,但对患者影响较小,如果能保持正常的运动功能,通常不需要治疗。在使用左旋多巴2-5年后,20%-50%的患者(每年10%)出现左旋多巴诱发的运动并发症。其病理生理机制包括外周药代动力学因素(如左旋多巴半衰期短,由于胃排空延迟和/或肠吸收衰竭导致胃肠道吸收不稳定)、中枢药效机制、突触前和突触后多巴胺能及5-羟色胺能传递部位的分子改变。左旋多巴相关运动并发症发生的危险因素包括累积使用左旋多巴剂量、每日左旋多巴剂量≥400 mg(和/或>4 mg/kg)、开始左旋多巴时较长的PD病程、女性、低体重和早发PD,特别是遗传性年轻型常染色体隐性PD(parkin、PINK1和DJ-1)。治疗根据上述左旋多巴引起运动并发症的危险因素,有一种观点认为,将左旋多巴治疗推迟到帕金森病晚期,特别是在70岁之前,将推迟这些副作用的发生,这种观点也得到了开放性研究的证实。另一方面,病程长和/或每日服用较大剂量左旋多巴已被证明在较短时间内出现运动并发症,这也证明PD的病程是症状波动和LID发生发展的关键因素。因此,目前常用的建议是在需要时尽早使用左旋多巴,以获得良好的症状控制和生活质量。一旦症状波动和LID开始,药理学管理的原则是通过增加多巴胺能药物的剂量、或左旋多巴采用小剂量多次给药的方式(左旋多巴剂量分级),或者通过改变左旋多巴的外周药代动力学,从而提供更连续和可靠的多巴胺能药物。虽然左旋多巴缓释制剂已经存在了很长一段时间,主要用于改善夜间和清晨的关期时间,但一种新的左旋多巴制剂- IPX-066(Rytary)最近在美国获得批准。它由不同大小的微球组成,以不同的速率释放左旋多巴,可提供更长的临床反应时间,与立即释放左旋多巴相比,每日“开”时间增加约3小时,与左旋多巴/恩他卡朋相比,增加1.5小时。添加透皮(罗替戈汀)或缓释(普拉克索、罗匹尼罗)DAs有助于改善运动波动。使用COMT抑制剂(恩他卡朋、托卡朋或奥匹卡朋)或中枢活性MAO-B抑制剂(司来吉兰、雷沙吉兰或沙酚酰胺)来延长多巴胺能突触的兴奋性是另一个已被证实的治疗策略。晚期帕金森病患者可以使用经皮十二指肠管使用左旋多巴/卡比多巴泵(Duodopa pump)或经皮下注射多巴胺激动剂阿扑吗啡。持续给药也可缓解早期帕金森病患者的LID,并有助于避免运动波动和LID的长期演变,但运动症状的药理学治疗这一概念仍需验证。如果改良药物输送策略失败,并且出现关期及“开-关”现象,“抢救”疗法包括左旋多巴分散制剂、肺内输送的左旋多巴可吸入粉剂制剂(Inbrija)(美国最近批准)和皮下注射多巴胺激动剂阿扑吗啡(APO-go-Pen)。目前唯一有效治疗LID的药物仍然是非竞争性NMDA受体拮抗剂金刚烷胺。在美国金刚烷胺作为缓释制剂(ADS-5102或Gocovri)提供,夜间服用68.5mg或137毫克胶囊,主要用于治疗LID和运动波动。医疗研究领域不断扩展,从多巴胺能领域药物扩展到涉及多个基底神经节突触传递通路的刺激或抑制非多巴胺能受体的药物。腺苷A2a受体选择性地定位于参与运动波动发展的间接纹状体输出通路的细胞体和突触。在众多已开发的腺苷A2A受体拮抗剂中,伊曲茶碱是唯一一种在大型临床试验中经过阳性检测的药物,迄今为止已在日本获得许可证,并且最近已被美国药品和食品管理局(Nourianz)批准在“关”期进行治疗。该药物在治疗冻结步态、姿势异常和认知功能障碍方面也让我们看到了希望。另一种作用于GABA和谷氨酸能突触的通常用作抗癫痫药物的非多巴胺药物唑尼沙胺,已经发现可以减少“剂末现象”,并且在日本也被批准作为一种治疗运动波动的药物。MAO-B抑制剂沙酚酰胺也具有抗谷氨酸的作用,也因此被认为除了增加开期时间外还可以减少运动障碍。与此同时,作为一种非药物治疗,丘脑底核和苍白球脑深部电刺激,已经被证明是一种对运动波动和LID都非常有效的方法。左旋多巴抵抗相关运动并发症的治疗除了左旋多巴引起的运动并发症外,帕金森病进展过程中常出现对左旋多巴反应不良的步态和平衡障碍、吞咽困难和构音障碍。在发病15到20年后,80%以上的患者会出现姿势不稳、步态僵硬和反复跌倒,一半以上的患者会出现吞咽困难和窒息。这些症状对晚期帕金森病患者的活动和生活质量有很大影响,但只有很少的试验评估药物治疗对这些症状的影响。MDS-EBM工作组在治疗PD步态障碍和可能减少跌倒方面指定的唯一可能有效和可能有用的药物是卡巴拉汀。但是胆碱酯酶抑制剂发挥这种作用的机制尚不清楚。来自同一类其他药物以及哌醋甲酯的试验结果无法让人信服,而且目前还不推荐用于该症状。Werner Poewe, Philipp Mahlknecht, Pharmacologic Treatment of Motor Symptoms Associated with Parkinson Disease. https://doi.org/ 10. 1016 /j.ncl.2019.12.002

